『公研』2021年6月号「私の生き方」
石野良純・九州大学大学院生物資源環境科学府農学研究院教授
ウイルスの戦略
――新型コロナウイルスが世界を覆う今の事態をどのように見ていますか?
石野 新しい感染症が一気に拡がることは可能性としては想定されていましたが、実際に起きて初めて状況を理解できるのだなと感じています。地球上に生命が誕生してから現在に至るまで、いろいろな生物が絶滅しています。その一方で未知のウイルスもたくさん棲息していますから、それが猛威を奮う可能性はこれからもあり得ることです。ウイルスの中には、ゲノムのなかに入り込んで眠った状態で生き続ける戦略を持つ種もいてそれが突如、誘導されて出てくることもあるんです。
生命体なのかそうではないのか定義しにくくなってきたこともあって、ウイルス自体が生物学の上で注目されてきた頃でもありました。新型コロナウイルスがどの時期に、どのように誕生したのか。それがどんなふうに眠っていて、今まで生き延びてきたのか。興味は尽きません。宿主が絶滅すれば、ウイルスも絶えることになりますからね。
僕たちが研究しているアーキアという生物からは今のところ病原性のある種は見つかっていませんが、出てこないとも限らない。万が一、病原性の強いアーキアが出てきた時には、やはり何らかの対策ができていないと困ったことになると、漠然とですが思っていました。
――PCR(ポリメラーゼ連鎖反応)検査が広く知られることになりましたが、導入をめぐっては意見が割れました。石野さんはPCR技術の発展にも貢献されていますが、どのように見ていましたか。
 石野 PCR検査が実用的なことは、早くからわかっていました。諸外国ではものすごい勢いで普及させて、網羅的にPCR検査をしていますよね。日本でそれができないはずはないんです。今ここ(九大の私の研究室)でもできますからね。陽性でも症状が出ない人がたくさんいることがわかっていて、彼らが感染を拡大させる元になっていました。感染が拡がる初期の頃から、PCR検査を徹底して行うべきだと僕はずっと感じていました。
石野 PCR検査が実用的なことは、早くからわかっていました。諸外国ではものすごい勢いで普及させて、網羅的にPCR検査をしていますよね。日本でそれができないはずはないんです。今ここ(九大の私の研究室)でもできますからね。陽性でも症状が出ない人がたくさんいることがわかっていて、彼らが感染を拡大させる元になっていました。感染が拡がる初期の頃から、PCR検査を徹底して行うべきだと僕はずっと感じていました。
――ワクチン接種も始まりました。
石野 蔓延を止めるには、今はワクチン接種しかありません。すでに変異株が出ていますから追い掛けっこになるのかもしれませんが、方法論としてはこれしかありません。
ワクチンにしても外国製に頼らざるを得ないのは、ちょっと情けない気がしています。日本は歴史的にはワクチン先進国だったわけだし、これだけの技術力を持ちながらなぜ今のような状況になっているのかよくわからないんですよね。小学校や中学校での各種ワクチンの集団接種をめぐっては一部ではネガティブな意見も見られましたが、一般国民が必ずしもそうした意識を共有しているわけではないように思うんですけれどもね。
母ひとり、子ひとり
――1957年、京都市のお生まれです。
石野 生まれたのは京都市ですが、生まれて間もなく長野県の岡谷市に越したそうです。父はジャノメミシンに勤めていて、ミシンが全国に普及していく頃に、各地に支店をつくっていました。岡谷の次は、和歌山の新宮市に転勤になりました。そこで父と母は離婚することになり、母の郷里がある京都の亀岡市に帰ることになりました。そのとき僕は3歳で記憶があるのは亀岡からです。隔離されている盆地で、当時は京都まで蒸気機関車で50分くらいかかりました。田圃ばかりでしたから、自然のなかを駆け回って遊んでいました。
母は洋裁をしていました。店舗を出しているお店から仕事を請け負ってきて、家で縫って納めるわけです。四畳半一間のアパートで僕と二人暮らしをしながら、母は家でずっと仕事をしていました。その日に困るような生活ではなかったけど、決して裕福ではありませんでした。
僕が小学校3年生の時に、大阪の吹田市へ引っ越すことになりました。都会のほうが、仕事に有利だろうと母は考えたわけです。
――子ども時代に科学を意識するようなエピソードはありますか?
石野 印象的だったのは、6年生のときの大阪万博ですね。地元ですから友だちと何度も行っては、パビリオンを見て回りました。アメリカ館にはアポロ11号が月から持ち帰った石が展示されていて、いつかは月を旅行できるようになるんだと想像を掻き立てられました。科学の力がもたらす未来に夢が膨らむような刺激を受けました。
ただ、子どもの頃は勉強よりも運動が好きでした。小学校のときは草野球ばかりやっていました。中学校では友人に誘われて、できたばかりのサッカー部に入ってしまったんです。サッカーはあまり好きじゃなかったんですね。入ってから後悔しましたが、途中で辞めるのも癪なので、3年間やり続けたんです。
サッカーの反動もあって高校時代は手を使うバスケットボール部に入りました。学校で一番厳しいクラブで、6時限目が終わるやいなや練習が始まり、星空が見える夜8時まで毎日フラフラになるまで練習がありました。疲れ切っていましたから、授業中はほとんど寝ていました(笑)。高校に入ってから始めたわけだから、最初は中学の経験者に追いつくのが精一杯でしたが、それでも一生懸命練習して新チームのスタメンに入れたんです。あの時は、とても嬉しかったですね。
――根性がありますね。
石野 1年生の時はまったく勉強しませんでしたから、学業が遅れることになり、2年生時の模試では、あまりに酷い成績でこのままではまずいとようやく気が付いた。母一人ですから、大学に行くにしても私立なんて行けません。とにかく国立をめざさなければと、それから勉強を頑張るようになるんです。
DNAの二重螺旋構造の美しさ
――その頃には生命科学や分子生物学を学ばれたいと考えていたのですか?
石野 高校の生物Ⅱの教科書に出てきたDNA(デオキシリボ核酸)の二重螺旋構造の図を見て、とても美しいと感じたんですね。遺伝情報を詰め込んだ生命を司っているDNAという物質の存在を知って、頭から離れなくなりました。それで生命科学を学びたいと決心したんです。そうすると医学部、薬学部、理学部、農学部あたりが候補になりますが、現役の時は医学部を受験しています。ここの事情は複雑なんです。僕は高校2年生の時に、ある開業医の診療所に母と一緒に住み込みで暮らしていました。経営者の医者は別にある自宅から医院に通っていました。母は洋裁をしながら、そこの管理人をしていたんです。そのお医者さんはだいぶ歳をとられていましたが、跡継ぎのご子息はまだ幼稚園に上がる前で小さかった。そこで「息子が成長するまでリリーフとして医院を助けてくれないか」という話があって「医学部を受けてほしい」とお願いされたんですね。
僕は生命には関心がありましたが、血を見るのは苦手でしたから解剖などは耐えられないと感じていました。それにバスケばかりしていましたから、医学部に届く成績ではなかった。それでも「浪人しても構わないから」とお願いされて、医学部を受験しました。結局、予定通り落ちました(笑)。
浪人することになりましたが、やはり医学部には向いていないから「辞めさせてほしい」とお願いして、大阪大学の薬学部に進みました。薬剤師の国家試験資格が得られますから潰しが効くと考えたんです。これは薬学部の特権ですよね。
――どんなテーマから研究を始められたのですか?
石野 阪大の薬学部に入ってみてわかったのですが、当時は有機合成化学、特に低分子化合物の合成が花形で、生命化学をやっている研究室がなかったんですよ。DNAやRNA(リボ核酸)などの核酸を扱う有機化学の研究室は一つだけで、「もう絶対にここしかない」という感じでした。4年生になって研究室を選ぶ時や大学院の面接を受けるときも、「ここを落ちたら、僕はもう行きません」と啖呵を切ったんです。第2希望の研究室ではやることがまったく違ってきますからね。絶対にそれはやりたくなかった。必死に勉強して何とか入れてもらうことができ、生命化学との付き合いが始まりました。
入った研究室では、DNAやRNAの塩基の鎖を人工的に合成していくことをやっていました。PCRの技術が確立された今ならば、プライマーとなる短いDNAは朝に注文すれば夕方には到着します。それも1本3000円くらいです。けれども、僕が大学院に入った1980年代初頭は、20個の塩基を繋げて合成するだけでも大学院博士課程のテーマとして通用するくらいでした。
僕は化学合成したDNAをDNAリガーゼで繋げたり、制限酵素で切ったり、DNAを修飾したりする(化学的に変化させる)と、どうなるのかという研究から始めました。やりたかったことですから、すぐに夢中になりました。
修士の時に最初に出した論文は、「EcoRI」という制限酵素をテーマにしました。この制限酵素が認識する配列中の糖の部分(デオキシリボース)を修飾したらどうなるのかという研究です。僕はそれ以来、現在に至るまでDNAやRNAなどの核酸に作用する酵素の研究を一貫してやっています。ゲノム編集技術としていま大きな注目を集めている「クリスパー・キャス9」もDNAを狙った箇所で切断する酵素です。
宝酒造に就職
――修士課程を終えると、宝酒造に就職されていますね。

石野 博士課程に進みたかったのですが、裕福ではなかったので修士を出て給料が欲しかったんです。当時は、家庭の事情が許される環境にある人でなければ、博士課程に進むことは難しいところがありました。それに修士を終えたら妻と結婚しようと決めていましたから、ドクターに進むと生活に困るのではないかという不安もありました。
宝酒造(現タカラバイオ)は、制限酵素を初めて国産化し売り出し始めた時期でしたから、遺伝子工学を学んだ研究者を欲していました。僕の薬学部時代の担当教授のところにも求人があり、が「行きなさい」と推薦いただき、宝酒造に就職したんです。ところが、僕にとってはたいへん幸運なことに、宝酒造から給料をもらいながら、引き続き阪大で研究を続けられることになりました。当時、研究室では遺伝子をクローニング(複製)することで、有用な物質をつくることに取り組んでいました。インシュリンや成長ホルモンのように我々が持っているけど、ごく微量しかできない生理活性物質を遺伝子工学で大腸菌につくらせることをやり始めた時期でした。宝酒造は、遺伝子クローニングには着手していませんでしたから、「阪大に残ってその勉強をしなさい」ということになりました。こうして、大阪大学の薬学部から微生物研究所に移って研究を続けました。遺伝子クローニングにするには、そちらのほうが有利だったんです。
博士課程に残らずに、ドクターの研究ができたわけですから本当に幸運でした。この時に狙っていたのは、骨粗鬆症に効くカルシトニンというホルモンでした。32個のアミノ酸からなるペプチドホルモンですが、遺伝子を化学合成してこれを大腸菌につくらせました。これが宝酒造初の遺伝子クローニングの成功例です。それから、DNAリガーゼと呼ばれる酵素の遺伝子を大腸菌からクローニングするプロジェクトを中心になって進めました。DNAリガーゼは、簡単に言えばノリです。ハサミである制限酵素で切断したDNAを繋げる酵素の遺伝子を大腸菌からクローニングに成功したのも、私が世界で最初のことでした。
このDNAリガーゼも宝酒造で商品化されました。学術的にも価値がありましたから、この研究を博士論文としてまとめました。結局、博士課程と同じくらいの期間で、博士号を取ることができました。DNAリガーゼの研究で自分のドクター論文を仕上げることができたし、商品化して売り出せましたから、まさに一石二鳥でしたね。
――会社から成果を出すようにとプレッシャーを掛けられるようなことはありましたか?
石野 あの当時は、割と大らかだったんですよ。もちろん毎月詳しいレポートを宝酒造には提出していましたが、現在に比べれば期限内に研究成果を求められるようなプレッシャーはあまりなかったですね。会社から言われたことは、「遺伝子クローニングの技術をきちんと習得してください」とそれくらいでした。しかし、大学に残って研究をさせてもらえたことには大きな感謝がありましたし、その期待に応えたい気持ちは強く持っていました。そのため、習得した知識と技術は会社に持って帰って、それを常時使って発展させたいという使命を常に意識していました。
ただ、DNAリガーゼの仕事を終えてからも宝酒造で勤務することはなくて、阪大の研究室に残り続けることになりました。この研究室では、大腸菌が環境適応するメカニズムを解明することをずっとテーマにしていました。特にリン酸が枯渇した環境下で、大腸菌がどうやってそれを克服して生き抜いているのかを追い続けていたんです。このテーマに関連するアルカリホスファターゼのアイソザイム変換に関する研究に従事することになりました。宝酒造にとってみれば、商品化には結び付くようなビジョンは見出せないテーマでしたが、最初の研究で一定の成果をあげられたので、「もうちょっといてもいいよ」という感じになったんですね。とても寛大な措置でしたから、今でも感謝しています。具体的にはiapという遺伝子を解析して、それにコードされているタンパク質を同定するというものでしたが、この研究がCRISPRの発見に繋がりました。結局、宝酒造に就職してから4年間、大阪大学の研究室にいたことになります。
――DNAの塩基配列を決定する作業とは、具体的にはどのような作業なのですか?
石野 本当に当時はこの作業が始まったばかりでしたから、たいへんな手間が掛かりました。一つの遺伝子を端から順番にずっと読んでいければいいんですが、当時はそういうコントロールはできなかったので、まずは解読したい遺伝子を制限酵素で細かく切り刻んで、小さく断片化します。それらを一つ一つ別々にクローニングして読み取れるくらいの量まで増やします。それらを個々に特殊な反応にかけて電気泳動で分離します。泳動し終わると、X線フィルム(昔のレントゲン検診で使われていた肺を移したフィルムと同じものです)を当てます。解読したいDNAは放射性物質で標識していますから、一晩置くとDNAのある位置は感光します。最後は写真を現像するように、暗室に閉じこもって、フィルムを現像液に浸けて現像します。感光されたフィルムの位置を一つひとつ目で追っていくことで、AGCTの塩基の配列が決定できるようになるんです。
一度の電気泳動で読めるのはせいぜい300くらいで、それ以上は不正確になってしまう。細かく切った断片の順番はランダムですから、個々のクローンの配列データを比べて重なっている配列を探しながらジグソーパズルのように繋げていきます。こことここが一緒だから次はここだなという感じです。決定できた配列をコンピューターに入力していきます。
クリスパーとの出会い
――たいへんな作業ですね。毎日続くとなると飽きてしまいそうです。
石野 実験操作がうまくいっても、当時の技術ではDNAの配列によっては正確に読めないものがありました(後述するようなpalindromicな配列)。そのような場合は、新たな工夫が必要でした。全部で1年以上かかりましたから、たいへんな作業でした。でも最初はおもしろかったですよ。解読したいDNAの塩基配列が自分の実験によって読めるようになったのはほんとに嬉しかったです。実際、この作業により結果を綺麗に出せるようになるまでは、トレーニングが必要なんです。例えば、記載された実験操作を見ながら実験してもすぐにはうまくいきません。プロフェッショナルな遺伝子操作実験技術が必要でした。この一連の操作には遺伝子工学実験として必須の操作が集約されていましたので、安定して解読可能な結果が出せるようになることは、当時の分子生物学実験者として合格を意味していたと思います。ただ、できるようになるとあとはもう同じ操作の繰り返しですから、早く完結させて終えたいなという気持ちにはなりますね(笑)。
こうしてDNAを解析することで、この遺伝子からどんなタンパク質ができるのかがわかるようになります。タンパク質のアミノ酸の配列を推定するために、遺伝子配列を決めなければなりません。
CRISPR(clustered regularly interspaced short palindromic repeat:クリスパー)とは、この地道な作業を行なっている最中に出会ったんです。先ほど述べたように、大腸菌が持つIap(isozyme conversion of alkali phosphatase)酵素をつくるDNAの配列を探っている際に発見されたものです。遺伝子配列を読んでいくと、ここからここまでの並びでタンパク質ができているのだなと推測できるようになるんですが、CRISPR配列はその並びの後に乗っていました。紹介したように、配列解析する際にはまず、遺伝子を短く切り刻み、それぞれをクローニングして独立に読みます。そうすると、同じような配列を含むクローンがたくさん出てきました。はじめは何故だろうと思って続けましたが、解析が進んでパズルが繋がってきますと、その謎は解けました。
全部で29の塩基がつながった配列を1単位として、その配列が5回繰り返されていて、間の部分――スペーサーと呼んでいます――にはそれぞれまったく違う配列が入っているんですが、スペーサーの長さは32塩基で一定していました(図1)。こんな奇妙で特徴的な配列に出会ったのは初めてでしたから、本当に不思議でした。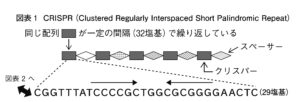
このような配列の前例は無く、当時の情報からはこれが生物学的に何を意味しているのかはまったく想像できませんでした。ただ、こんなに綺麗に揃っているのは偶然ではなく、何らかの役割を果たしていることは間違いないだろうとは感じていました。当時は、この配列を正確に決定して発表することに一生懸命取り組みました。間違っていたら後で格好悪いですからね。この時はIap酵素について述べることが主要な目的でしたし、それは十分に達成できていたので、投稿論文としては文句なく受理されましたが、論文の最後にこの不思議な繰り返し配列についても図を作成して掲載するとともに、「現時点ではこれと同様の配列は他の原核生物には見当たらず、生物学的な意味は不明である」と明記しました。この論文が発表されたのは1987年で、当然CRISPRという言葉もまだありません。
――当時CRISPR配列の働きについてどのような仮説を立てたのですか?
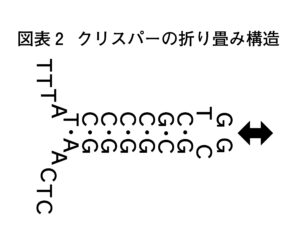
石野 CRISPRの最後のPRは(palindromic repeat)ですが、palindromicというのは回文配列という意味なんです。AGCTの塩基配列にそれぞれ補完する関係にあるペアになる塩基が配列されていて、一本のDNAの鎖のなかでA-T, G-Gが塩基対を作って折り畳める構造になっています(図1-2)。なので、遺伝子発現の何らかの調節に関わっているのではないかとは想像しました。酵素を生成するのであれば、こうしたDNA配列があると、そこで止まってしまうことになりますからね。CRISPRは気になる存在ではありましたが、さらに研究を進めることはせずにしばらくの間は放っておかれることになるんです。
――なぜですか。せっかくの発見なのにもったいない。
石野 当時の情報ではCRISPRの機能は想像できなかったし、分子生物の本場であるアメリカの研究室を経験したかったんですね。ちょうどその時に、薬学部時代の恩師がイェール大学の教授に僕を推薦してくれて、受け入れてもらえることになったんです。宝酒造もアメリカ行きを認めてくれましたから、決心しました。何か特定の研究をやりたかったわけではありませんが、研究者としては海外の研究室に所属して、そこで生活をしてこなければダメだという強い思いがあったんです。イェール大学には約2年間いましたが、それまでとはまったく違う、RNAからタンパク質に翻訳される過程に関する酵素の研究に没頭しました。それでCRISPRのことは忘れてしまったわけです。
アーキアとは?
――石野さんのご専門であるアーキアとの出会いの経緯は?
石野 PCRは実用化されたのは、僕がイェールにいた1988年のことでした。宝酒造の研究所長がアメリカに飛んできて、PCRを実用化したパーキンエルマー・シータス社と独占契約を結ぶんです。本社は大学から車で1時間くらいのところにありましたから、僕も契約の場に立ち会っています。宝酒造はライセンスを持ち帰り、PCRの技術を日本で普及させていきました。僕は89年に帰国してPCR関連商品などをケアする仕事に携わっていましたが、やはり研究者としてはアメリカの製品を輸入して販売するだけではおもしろくありません。自社製品をつくるために、ずっとPCRの勉強を続けていました。
生物の三つの系統(細菌、真核生物、アーキア)の一つであるアーキアの存在に関心を持つようになったのもこの時期でした。PCRの技術には、熱に安定性の高いDNA合成酵素(DNAポリメラーゼ) が必須になりますが、これは微生物由来なんです。地球上には高い温度で生育している好熱菌という微生物がいますが、PCRに使われているTaqポリメラーゼは、「Thermus aquaticus」という高度好熱菌の酵素です。けれども、地球上にはそれよりもっと高い、100度のような環境でも生きていける超好熱の生物が存在しており、それらは細菌(バクテリア)とは異なる性質を持ったアーキアであることを知りました。そこで僕はいろいろなアーキアを触ってみて、PCRに使える酵素を取り出す試みを始めるんです。
――逞しい生き物ですね。
石野 そうなんです。そこでまた、おもしろいなと思ったんですね。そんな過酷な環境でどうやって自分の遺伝情報を複製して2倍、4倍と増えていくのか、ということに興味を持ちました。PCR技術の改良・開発研究を続けながらも、アーキアをアカデミックに研究してみたいという思いがどんどんと募るようになったんです。ちょうどその頃に、官民共同プロジェクトが立ち上がりました。経済産業省と民間の大手16社が共同出資して期限付きの生物分子工学研究所ができて、そこから声が掛かりました。そこで、当時の宝酒造バイオ研究所長であった加藤郁之進さん(後にバイオテクノロジー分野を独立させて、タカラバイオという新しい会社をつくって初代社長になられた)に、基礎研究のために外へ出して欲しいと頼み込みました。最初はあまりいい顔をされませんでしたが、最後は理解してもらい気持ちよく送り出してもらえました。
そこからアーキア研究を本格的にスタートさせました。当時アーキアの遺伝情報系の研究は、世界中ではほとんどやられていなかったので、何をやっても新しい発見になりました。大学と違って、講義などの義務はありませんでしたし、研究費も潤沢にありましたので、最高の研究環境でした。論文もどんどん出せましたし、世界でのこの分野の先端的地位も確立しました。けれども時限付きの研究所ですから、次の就職先があるかどうかだけが不安でした。出資企業から参加していた研究者は元の企業に戻れましたが、宝酒造は出資企業に入っていなかったので、私は退路を絶って参加していましたので、頑張って就職活動をしました。大学の公募案内を調べて、自分の専門分野から応募できそうなところに出していきました。幸いにして九州大学が拾ってくれて、大学で研究室を持つことがでいました。それ以来、現在までアーキアの研究を続けています。
――アーキアの研究ではどのようなことを明らかにしようとされているのですか?
石野 最近のメタゲノム解析によって、アーキアは地球上の様々な環境に広く生息していることがわかってきましたが、僕は温泉や火山、海底熱水噴出孔などの過酷な環境にいる超好熱のタイプに関心があります。水が沸騰してしまうような環境にDNAの2本鎖を置いたら、通常は水素結合は外れてしまいます。我々の常識からすれば、それでは遺伝情報をキープし続けて生きていくことはできません。このような環境ではAGCTが化学的に変わってしまって、遺伝情報がどんどん変異してしまうはずです。ところがアーキアは、太古から現在に至るまで自分の種を保存してきている。ですから、変異を効率よく修復して遺伝情報を守る高度なメカニズムが絶対にあるはずです。それを解明したいという思いでずっと研究を続けています。その答えは完全に出ていませんが、この研究を通して、私の研究室ではアーキア特有の新たな修復酵素が数年ごとに発見され続けています。最近では、2016年にも超好熱のアーキアから、ミスマッチ塩基対(A-T, G-Cではないもの)を認識して二本鎖とも切断する独特の酵素を見つけました。この研究から新たな研究が広がってきています。また、そろそろ次の新たな酵素の発見が期待される時期です。
地球上のあらゆる生き物は3種類に分類される
――地球上の生物は三つに分類されるという「3ドメイン説」が定着しています。アーキアはその一つですが、どういう考え方なのでしょうか?
石野 3ドメイン説は、細胞の機能や遺伝情報が載ったDNAの複製の仕方を比較することによって、地球上のすべての生物を三つに分ける考え方です。生命の起源は誰も見たことがなく想像するしかないのですが、そこから進化して共通の祖先を仮定すると、そこから、バクテリア(細菌)ドメインと、アーキア・ユーカリア(真核生物)ドメインに分かれたのではないか(図2)、そして、アーキアとユーカリアには共通の先祖がいて、どこかの時点でそれが二つのドメインに別れて進化してきたと考えます。ドメインを区別する根拠になっているのは、細胞の構成の違いや、生命現象を動かしている整体分子の構造の違いです。すなわち、見た目ではなく構成分子の違いで判断しています。分子が違いますと、生体反応のメカニズムも異なります。たいへん面白いことに、我々ヒト細胞のDNA複製を司る多くのタンパク質は、単細胞で核を持たないアーキアのものとよく似ており、ヒトがアーキアと共通の祖先を有することが分かります。バクテリアのものとは明らかに異なります。ヒトの生命を維持している基本的なメカニズムはアーキアと共通しているので、アーキアを研究すればヒトのことがもっと理解できるようになるはずだと思って続けています。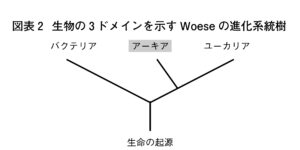
最初にアーキアがバクテリアと異なることが報告された論文では、アーキバクテリア(archaebacteria)と提唱されました。archaeは原初、根源という意味ですから、日本に最初に入ってきた時に「古細菌」と翻訳されて定着してしまいました。だけど、これだとバクテリアの仲間のように見なされてしまう。もしくは、古いバクテリアのような謝ったイメージを与えてしまうので適切ではないんです。3ドメインの一つとして間違ったイメージを与えないように、古細菌ではなくてアーキアと呼ぶべきなんです。
――三つのドメインは、それぞれ異なる細胞のメカニズムを持っているわけですね。
石野 生物ならば絶対に持っているリボソームというタンパク質を合成する細胞小器官がありますが、これを分析するとドメインが三つに分類されることが明快にわかります。これは顕微鏡で見ても違いがわかりませんから、一般の方に説明することはなかなか難しいところがあります。けれども、リボソームのRNAを分析すると、三つのドメインはそれぞれ対等に遠いんですね。まったく違う生物だと考えなければ、生物学的にはおかしいんです。
クリスパーは微生物の免疫システムだった
――話題をCRISPRに戻します。90年代以降になると謎に包まれていたCRISPRの役割が次第に明らかになります。
石野 スペインのアリカンテ大学のフランシス・モヒカのチームは、超好塩性のアーキアが高い塩濃度の環境に適応するためのシステムを研究していたのですが、アーキアにもCRISPRが存在することを見つけました。1993年のことです。これで、3℃メインのうち2つはCRISPRを有することが分かりました。その後、ゲノム配列情報の蓄積によってCRISPRを有する生物の例が増え、今ではアーキアの90%はCRISPRを持っていることがわかっています。ちなみにバクテリアは半分ぐらいしか持っていません。
21世紀に入ると、CRISPR配列の報告が増えて、様々な名称が提唱されたので、混乱を防ぐために、“CRISPR”という名称が提唱されました。それと同時に、CRISPR配列の近傍に必ず存在する遺伝子群があることも発見されて、cas(CRISPR-associated) 遺伝子と名付けられました。cas遺伝子はタンパク質をコードしており、その遺伝子産物をCasと呼びました。CRISPRとCasは、共同して何かの機能を担うのだろうと想像されたわけです。しかし、依然としてその具体的な機能はわかりませんでした。機能解明のきっかけは、繰り返し配列の間を隔てているスペーサーの部分に、バクテリオファージやプラスミドの遺伝子断片が含まれている例が発見されたことによります。すなわち、これらはかつて外から攻撃してきたウイルスやプラスミドから細胞を守っている防御機構に関係するのではないかという仮説が建てられました。バクテリアやアーキアが、自分の害になり得るウイルスやプラスミドの顔写真を自分自身のゲノムDNAの塩基配列の中に記憶しているというわけです。
――微生物がDNAに外敵の情報を取り込んで記憶していたことには驚かされました。
 石野 ものすごく複雑ですよね。このような巧妙なメカニズムを獲得したとは、確かに生物の細胞というのはよくできていると思います。このシステムの構築は一瞬にして成り立つことではないので、長い時間をかけて段々と良いシステムになっていったのだと思うんです。この発見によって、CRISPR−Casがバクテリアやアーキアの免疫機構ではないかと考えられるようになっていきましたが、誰が最初にそのことを言い出したのかは、あやふやなところがあるんですね。例えば、NIH(アメリカ国立衛生研究所)の研究者たちが、スペーサーに存在するウイルスやプラスミドの配列を見て、これはひょっとしたらCRISPR−Casが、真核生物のRNAiのシステムに似た遺伝子発現の不活化のメカニズムによって、外来の進入物から身を守っているのではないかと言い出したこともすごく大事なヒントだったと思います。
石野 ものすごく複雑ですよね。このような巧妙なメカニズムを獲得したとは、確かに生物の細胞というのはよくできていると思います。このシステムの構築は一瞬にして成り立つことではないので、長い時間をかけて段々と良いシステムになっていったのだと思うんです。この発見によって、CRISPR−Casがバクテリアやアーキアの免疫機構ではないかと考えられるようになっていきましたが、誰が最初にそのことを言い出したのかは、あやふやなところがあるんですね。例えば、NIH(アメリカ国立衛生研究所)の研究者たちが、スペーサーに存在するウイルスやプラスミドの配列を見て、これはひょっとしたらCRISPR−Casが、真核生物のRNAiのシステムに似た遺伝子発現の不活化のメカニズムによって、外来の進入物から身を守っているのではないかと言い出したこともすごく大事なヒントだったと思います。
CRISPR−Casが獲得免疫システムであることを、最初に実験で証明したのは、チーズやヨーグルトなどの乳製品を製造しているデンマーク発祥のダニスコ社の研究員であったロドルフ・バラングたちの研究チームでした。ヨーグルトを生産するための大事な乳酸菌がファージ(ウイルス)に感染して死んでしまうことを防ぐための研究として、乳酸菌が有するCRISPRの中にファージのDNAが挿入されていると、そのファージに感染しなくなり、CRISPRからウイルスDNAを取り除くと感染することを明快に証明しました。これにより、CRISPR−Casの機能がついに明らかになりました。CRISPR−Casの機能については様々な説が提唱されましたが、決定的な証拠がなく、多くの研究者の努力の積み重ねの結果、真の機能が解明されました。これが解明されるまでの期間にいろいろなアイデアや実験データが示され、議論されて、種々の仮説が提唱されたことが科学の進展にとってすごく大事なことだったと思います。
その後、研究の進展は加速し、CRISPRの中に取り込まれているDNAと同じ配列のDNAをCasタンパク質が切断することで、CRISPR−Casが機能を発揮することが証明されます。そのメカニズムを最初に明らかにしたのは、僕のアーキア研究仲間の一人であるオランダのジョン・ファン・デア・オーストです。彼は私の発見した大腸菌のCRISPRを使って、そのことを証明しました。僕のCRISPR発見からゲノム編集ツールとしてのクリスパー・キャス9が確立されるまでには、非常に多くの人たちの様々な貢献があったわけです。それぞれが大事な発見をしていますよね。
クリスパーキャス9が変える人類の未来
――けれども、2020年にノーベル化学賞を受賞したのは、最後のゲノム編集技術を開発したジェニファー・ダウドナとエマニュエル・シャルパンティエの二人でした。
石野 ノーベル賞の受賞理由が「ゲノム編集技術の開発」でしたから、一連の発見の最後だけが評価されたということだと思います。その観点から言えば、リトアニアのビリュニュス大学のビルギニユス・シクスニス博士も同じ発見をして1ヶ月の差で論文を発表していますから、本当にタッチの差ですよね。ゲノム編集技術の開発が選考理由だとすれば、ビルギニユス・シクスニス博士が入っていてもよかったかもしれません。客観的に見てそう思いました。もちろん、二人のノーベル賞受賞によって僕の研究成果も顧みられて、評価いただいたことは光栄なんですけどね。
シャルパンティエとダウドナは、CRISPR−Casが侵入してきたウイルス、ファージ、プラスミドDNAを選択的に切断する機構を応用して、ゲノム編集に使えることを示しました。Casタンパク質にはいろいろな種類がありますが、Cas9は単独のタンパク質としてDNAを切るハサミの働きをします。そして誘導するCRISPRの配列を人工的に操作することで、ウイルスに限らず、どんな遺伝子でも狙ったところへハサミであるCas9を連れていって、DNAの二本鎖を切断できます。狙った箇所に、別の塩基配列を挿入することもできるわけですから本当に画期的な技術です(図4)。
――クリスパー・キャス9は、生命科学技術を根本から変えるのではないかとも言われていますね。
石野 間違いなく使用が増えていきますよね。クリスパー・キャス9は、今でも使いやすいのですが、PCRがそうだったように使えば使うほどに改良されていくことになるでしょう。それによって、ますます便利で信頼性のある技術に成長していくと思います。すでに農業分野では実用化が進んでいますが、今後は医療分野で普及していくことになるでしょう。遺伝子のどこがどのように変化すれば、どういった病気になるのかこれからどんどん解明されるでしょう。そこがわかれば、ゲノム編集によって切る――ノックアウトと言います――ことができます。遺伝子治療をしなければ、他に方法がない病はたくさんあります。それを治療する上では、クリスパー・キャス9を用いたゲノム編集を行うことは、人類にとってものすごいアドバンテージになります。例えば、遺伝子的に疾病が子どもに引き継がれてしまうようなケースでは、受精卵にゲノム編集を施すことによってそれを避けることが可能になる。
「オフターゲット」と呼ばれていますが、狙った箇所とは違うところに触れてしまうことで、他に悪影響が出るのではないかという懸念はあります。ゲノム編集をすることで、まったく予想外のことが起きないとも限らないと心配する人もいます。DNAはすべてが遺伝情報として機能しているわけではなくて、必要ではない部分はジャンクDNAと言われたりしています。けれども、それらの中にも実は重要な働きをしているものもあるのではないかと疑う人もいます。そうしたことまで考え出すと問題が100%なくなることを期待するのは、絶対に難しいことです。
それを言い出すと、せっかくの技術も本当に使えなくなってしまう。
ですから、やりっぱなしにするのではなくゲノム編集をした後にすべてのゲノムに与える影響を確認する作業は必要になります。そうした解明を延々と積み上げていくが求められる。安全性が確認されたものだけを現実に社会に出していくことだろうと思います。
――ゲノム編集による遺伝子治療は、成人した人に適用することも可能なのでしょうか?
石野 今の臨床医の先生たちは期待を持って、研究を進めておられると思いますが、将来的には成人にも用途が拡がってくるのではないかと思っています。クリスパー・キャス9のゲノム編集は、狙ったターゲットに別の遺伝子を運ぶデリバリーシステムでもあります。そうした付随した技術の発展がこの先どんどん進むことになりますから、総合的にいろいろな使われ方がされることになるのだと僕は思いますね。
特徴的な現象には必ず意味がある
――人類は自然の理解を深めているのか、それともわからないことのほうが増えているのでしょうか。どのように感じていますか?
石野 自分が学生だった頃を振り返ると、わからなかったことがわかるようになった印象がすごく強いですね。大腸菌の塩基配列をフィルムに現像して読んでいた頃には、ヒトの全ゲノム配列を解読するなんて絶対に不可能だと思っていましたから、ポストゲノム時代の今、実感としてはものすごく進歩していると感じます。もちろん、新たにわからないことが拡がった感覚もあります。だから、今は次の世の中の姿を想像しにくい時代なのかもしれませんが、それらを克服していくスピードは加速している気がしています。
その一方で、今の日本の若い人たちは一般的に科学にたいする好奇心が落ちてきているのではないかと不安も感じています。我々の時代とは生活環境も大きく異なり、何でもちょっとネット検索すると何かの応答が得られますが、それで終わりではなく、もっといろいろなことに興味を持って貪欲に取り組んで本質を追求して欲しいとも思うんですね。
CRISPRは何を意味するのかわかりませんでしたが、特徴的な現象には必ず意味があるし、わからないからこそおもしろかったのです。学術的にすでに高く評価されている対象や、社会に役に立つことが見えているテーマはもちろん推進すべきものですが、まだ何の意味があるのかわからないものへの関心もたいへん重要です。わからないけどおもしろいと思えるかどうかは、普段からどのくらいアンテナを貼っているかと関係します。わからないものをおもしろいと感じられる精神が次のブレイクスルーを引き起こすのだと思っています。そして、純粋に「おもしろい」と思えるものを研究できるような環境が与えられることも、日本の科学にとってたいへん重要なことだと思います。
――ありがとうございました。聞き手:本誌 橋本淳一
![集中連載 「コロナの時代」の 戦略思考 [第3回]「巣ごもりの地政学」](https://koken-publication.com/wp-content/uploads/2022/12/池内先生-150x150.png)






